6月22日,国际顶级学术期刊《Angewandte Chemie-International Edition》在线发表了东南大学生物科学与医学工程学院数字医学工程全国重点实验室梁高林教授课题组的研究成果,文章标题为《Tandem Guest-Host-Receptor Recognitions Precisely Guide Ciprofloxacin to Eliminate Intracellular Staphylococcus aureus》。该项研究基于前期CBT-Cys点击反应的研究基础,首次提出了一种客体-主体-配体串联识别的策略(Tandem Guest-Host-Receptor Recognitions),引导环丙沙星在感染的巨噬细胞内精准递送、智能组装及响应性释放,从而实现胞内金黄色葡萄球菌的高效清除。(Angew. Chem., Int. Ed.2022, DOI: 10.1002/anie.202306427)。
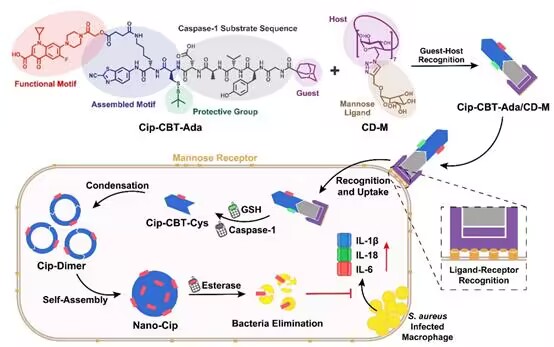
细胞内隐匿的金黄色葡萄球菌与多种严重(甚至致命)的感染疾病相关,如皮肤和软组织感染、肺炎、败血症和心内膜炎等。抗生素是目前临床上治疗细胞内金黄色葡萄球菌感染的首选。然而,由于宿主细胞的细胞膜屏障和外排泵等的存在,直接使用抗生素的治疗效果往往不佳,并且容易产生耐药。针对这一难题,东南大学梁高林教授团队合成了一种环丙沙星-多肽偶联分子Cip-CBT-Ada(见上图)。该分子由以下几个部分组成:1)抗生素环丙沙星;2)CBT和StBu保护的Cys,用于CBT-Cys点击反应;3)半胱氨酸蛋白酶-1(Caspase-1,一种感染过程中过度表达的酶)特异性识别的多肽底物YVAD;4)客体分子金刚烷(Ada)。首先,作者通过紫外-可见滴定实验,验证了Cip-CBT-Ada可以通过客体-主体识别作用与甘露糖七取代的β-环糊精(CD-M)结合形成超分子Cip-CBT-Ada/CD-M。细胞实验表明,Cip-CBT-Ada/CD-M可以利用环糊精上的局部高甘露糖密度,通过多价态配体-受体识别作用特异性靶向巨噬细胞。接着,Cip-CBT-Ada/CD-M在胞内Caspase-1和谷胱甘肽的激活下,发生CBT-Cys点击反应生成环状二聚体Cip-Dimer并进一步原位自组装形成环丙沙星纳米粒子Nano-Cip。最终,环丙沙星纳米粒子Nano-Cip在酯酶的作用下持续、缓慢释放环丙沙星,从而高效杀灭胞内金黄色葡萄球菌。作者通过体内外实验证实了,与游离环丙沙星和Cip-CBT-Ada单体相比,超分子Cip-CBT-Ada/CD-M具有更强的胞内细菌清除和炎症治疗的能力。该工作为胞内细菌感染的抗生素治疗提供了一种新的思路和策略。
该论文共同第一作者是东南大学副研究员占文俊博士、博士生徐玲玲和硕士生刘智宇。通讯作者为东南大学首席教授/数字医学工程全国重点实验室副主任梁高林教授。该研究得到了科技部重点研发计划,国家自然科学基金重点项目和青年科学基金项目的资助。
附文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202306427
供稿:生物科学与医学工程学院

